#acessibilidade: Na foto é mostrado John Goodenough após receber o prêmio Nobel, ao fundo temos diversas pessoas aplaudindo e uma imagem da medalha do prêmio Nobel.
Texto escrito pelo colaborador Vitor Hugo Paschoal
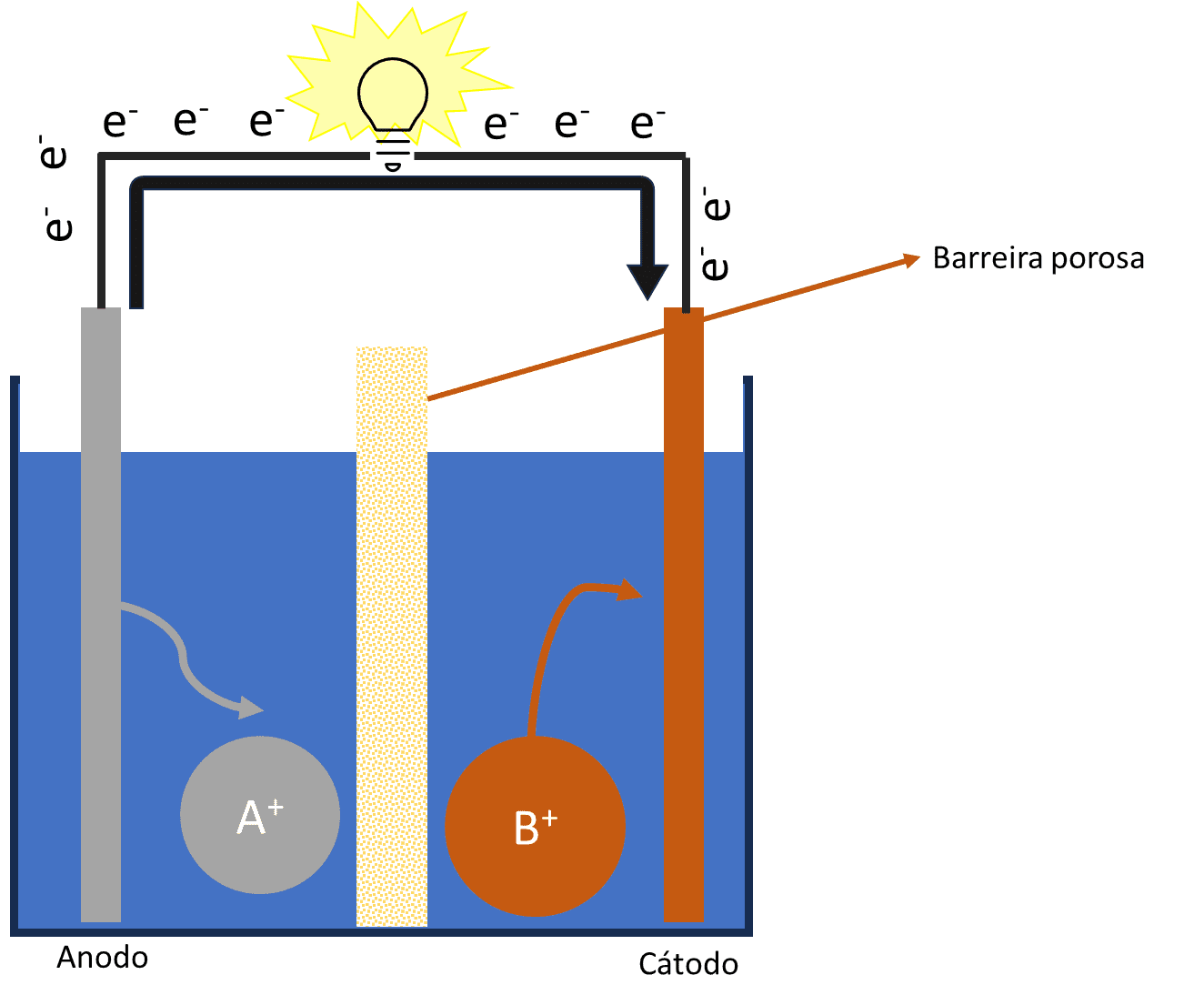
John Bannister Goodenough nasceu em Jena, na Alemanha, em julho de 1922, durante o período que seu pai, um estudioso da história da religião, fazia seu doutorado em Oxford. Este cientista que faleceu no dia 25 de junho de 2023 (faltando um mês para completar 101 anos) é um dos mais velhos a receber o prêmio Nobel (prêmio Nobel de Química de 2019) por suas contribuições no desenvolvimento de baterias de íon-Li, prêmio que foi dividido entre ele, M. Stanley Wittingham e Akira Yoshino. Este tipo de baterias foi mencionado anteriormente no Guia (Pilhas de primeira e segunda geração. Guia dos Entusiastas da Ciência. v. 1, n. 4, p. 5, 2018), como pilhas de segunda geração. Mas qual foi a contribuição de Goodenough especificamente? Para responder essa pergunta precisamos entender o funcionamento de uma bateria: este tipo de dispositivo possui um cátodo (em laranja) e um ânodo (em cinza) e um eletrólito (como uma solução contendo esses íons, em azul) que faz o contato das duas partes (como mostrado na Figura 1) separados por uma membrana semi-porosa (em amarelo com bolinhas). O ânodo cede elétrons (no chamado processo de oxidação) que são conduzidos por um circuito externo na forma de uma corrente elétrica. Essa corrente elétrica pode ser aproveitada para fazer algum tipo de trabalho (como mover um motor ou acender uma lâmpada).
Figura 1: Esquema de uma bateria: dispositivo possui um cátodo (em laranja) e um ânodo (em cinza) e um eletrólito (como uma solução contendo esses íons, em azul) que faz o contato das duas partes (como mostrado na Figura 1) separados por uma membrana semi-porosa (em amarelo com bolinhas). O ânodo perderá elétrons gerando as espécies oxidadas A+ que fornecerão elétrons para o circuito externo que poderão reduzir íons B+, do material do cátodo (para B) ou poderão ser utilizados para realizar trabalho. No caso da imagem, para gerar luz. Fonte: o autor.
Um bom ânodo pode ser um metal que perca elétrons facilmente, isto é, é facilmente oxidável. A diferença entre a facilidade do ânodo ser oxidado (potencial de oxidação) e do cátodo ser reduzido (potencial de redução) resulta no potencial que pode ser fornecido na bateria, sendo esse potencial, medido em Volts. Por exemplo, supondo que A seja Zn e B seja Cu (a chamada pilha de Daniell), podemos gerar um potencial de aproximadamente 1,10 V, com o Zn sendo oxidado a Zn2+ e o Cu2+ sendo reduzido a Cu.
Aí entra o Lítio na história, que é muito bom nesta tarefa e poderia gerar potenciais de até 4 V. A outra parte importante na bateria é o cátodo, onde o íon formado no ânodo, após perder um elétron, pode ser reduzido (isto é, receber o seu elétron de volta). Na década de 1960 Schroeder e Rouxel descobriram que uma boa estratégia para se obter baterias recarregáveis seria a partir da intercalação de Li+ (íon-Li) em dissulfetos de metais de transição (MS2). E em 1976 Whittingham (um dos ganhadores do Nobel com Goodenough) descobriu que um bom material para intercalar os íons Li seria o dissulfeto de titânio (TiS2). O problema é que o Li é um metal extremamente difícil de se trabalhar podendo, através de curtos-circuitos incendiar eletrólitos orgânicos causando até mesmo explosões. Goodenough tinha que enfrentar o seguinte dilema: é desejável ter Li na bateria porque assim poderemos ter altos potenciais, mas ter Li-metálico é indesejável pelo risco inerente de se usar esse material. Baseado na sua experiência com Donald Wickham na década de 1950, Goodenough resolveu estudar quanto Li ele poderia tirar de um óxido de metal de transição da forma LiMO2, onde M eram metais como o Crômio (Cr), o Cobalto (Co) e o Níquel (Ni). A escolha destes metais tinha a ver com a capacidade de formarem pares de redução do estado M4+ para M3+, com potencial mais baixo que o ânodo de Li. Goodenough junto com seus alunos, demonstrou que para compostos com M=Co ou Ni, o Li poderia ser removido reversivelmente. A peça final do Nobel veio com o trabalho de Yoshino, que partindo destes resultados substituiu o Li por grafite.
Apesar do prêmio Nobel de Química e todo o seu trabalho com eletroquímica, Goodenough não era químico de formação. Na verdade, ele ingressou em Yale almejando um diploma em artes liberais, onde estudou literatura, filosofia, e línguas clássicas, além de matemática, sendo o seu único contato com química um curso introdutório, necessário para a obtenção do seu diploma. Na verdade, contar a vida de Goodenough a partir das suas contribuições que resultaram no prêmio Nobel é quase como contar uma história a partir do final. Após obter seu título de bacharel em artes em 1943 por Yale, serviu na força área americana entre 1943 e 1946 como metereologista. Obteve os títulos de mestre e doutor em física (na área de física do estado sólido) em 1951 e 1952, respectivamente. No período de 1952-1976 trabalhou no Lincoln Laboratory do Massachussets Institute of Technology (MIT), desenvolvendo como parte da equipe de Jay Forrester (um dos inventores da memória RAM). Neste período também fez grandes contribuições para a compreensão do magnetismo em cristais. Passou a década de 1970 sob um embargo que proibia pesquisas fundamentais em laboratórios financiados pelo governo. Em 1976 se torna chefe do Laboratório de Química Inorgânica da Universidade de Oxford, sendo que as suas contribuições para o prêmio Nobel só são feitas em 1980 (como mostra a placa comemorativa da Figura 2). Cabe mencionar, que da década de 1980 até 2019 (quando ganhou o prêmio Nobel), Goodenough continuou trabalhando na Universdade do Texas em Austin.
Figura 2: Placa comemorativa da Royal Society of Chemistry reconhecendo o Laboratório de Química Inorgânica da Universidade de Oxford como um marco nacional da ciência em 2010, pela descoberta de materiais para o cátodo de baterias de íon-Li recarregáveis em 1980 por John B. Goodenough, Koichi Mizushima, Philip C. Jones e Philip J. Wiseman. Fonte da imagem: Kastrel Licensa: Creative Commons Attribution-Share Alike 3.0 Unported.
Olhando a carreira de John B. Goodenough vemos um cientista apaixonado que conseguiu superar sua dislexia e cuja produção científica abrange desde trabalhos fundamentais (como seus trabalhos sobre ordenamento orbital e magnetismo) até descobertas absolutamente aplicadas como as baterias de íon-Li e memórias RAM (que possivelmente estão viabilizando que você leia este texto agora). Muito além das disciplinas convencionais, se considerava um cientista do estado sólido: nem químico, nem físico. Ele queria ser um explorador e escolheu a ciência como seu campo de exploração.
Fontes:
Nobel Prize Outreach AB. John B. Goodenough. Biographical. Disponível em: https://www. nobelprize.org/prizes/chemistry/2019/goodenough/biographical/. Acesso em: 26 de junho 2023.
Neil Weathers. In situ with John Goodenough. Disponível em: https://www.chemistryworld.com /culture/i-wanted-to-be-an-explorer/3007501.article. Acesso em: 26 de junho 2023.
Bea Perks. Goodenough rules. Disponível em: https://www.chemistryworld.com/features /goodenough-rules/8099.article. Acesso em: 26 de junho 2023.
Bernadette Bensaude-Vincent, Arne Hessenbruch. Interview of John B. Goodenough. Disponível em: http://authors.library.caltech.edu/5456/1/hrst.mit.edu/hrs/materials/public/Goodenough/Goo denough_interview.htm. Acesso em: 26 de junho 2023.
Hugo Suffredini. Pilhas de primeira e segunda geração. Guia dos Entusiastas da Ciência. v. 1, n. 4, p. 5, 2018. Disponível em: https://gec.proec.ufabc.edu.br/o-que-que-a-ciencia-tem/pilhas-de-primeira-e-segunda-geracao/. Acesso em: 26 de junho 2023.
Robert D. McFadden. John B. Goodenough, 100, Dies; Nobel-Winning Creator of the Lithium-Ion Battery. The New York Times: Disponível em: https://www.nytimes.com/2023/06/26/ science/john-goodenough-dead.html. Acesso em: 26 de junho 2023.
Figura 2. Kastrel. Inorganic-chemistry-lab-Oxford-plaque.jpg. Disponível em: https://commons.wikimedia. org/wiki/File:Inorganic-chemistry-lab-Oxford-plaque.jpg. Acessa em: 26 de junho 2023.
Outros divulgadores:
Para saber mais:
Nobel Lecture por John Goodenough. Disponível em: https://www.youtube.com/watch?v=Xlm-C-qr63Y. Acessado em: 26/06/2023.
Podcast: At 97, lithium-ion battery pioneer John Goodenough says his work is not done. Disponível em: https://cen.acs.org/people/profiles/Podcast-97-lithium-ion-battery/97/i35. Acessado em: 26/06/2023.