#acessibilidade: A imagem destacada mostra um esquema de um microscópio de tunelamento (à esquerda), com bolinhas verdes mostrando um substrato e bolinhas vermelhas mostrando uma ponta de prova. A ponta de prova está conectada ao substrato por linhas pretas. À direita é mostrada uma tabela de afinidade em preto e branco.
Texto escrito pelo colaborador Vitor Hugo Paschoal
É parte da natureza humana tentar compreender a sua origem, sendo que perguntas girando em torno do que somos feitos, no sentido material e não filosófico, motivam a construção de modelos para explicar a realidade desde os filósofos gregos. Moléculas não são a menor parte da matéria, sabemos dos elétrons, dos prótons, nêutrons e toda espécie de partícula subatômica gerada tanto nos confins do universo quanto em aceleradores de partículas. Estas entidades que compõem tudo ao nosso redor, inclusive a você e a mim, podem conter toda a sorte de elementos químicos, que por sua vez podem interagir, se unir, formando arranjos no espaço que podem ser os mais diversos possíveis. A “força” com que essa união se dá, que pode ser mais ou menos forte, será o ponto de partida para o estudo do conceito de ligação química. A forma com que esses átomos se unem, no sentido da sua organização no espaço, será o ponto de partida para a discussão da estrutura molecular. Tudo isso dito, isto é, sabendo que moléculas são formadas por átomos que se unem por ligações químicas assumindo uma determinada estrutura, fica a pergunta, como sabemos que moléculas existem?
Hoje em dia, sabemos que moléculas existem porque podemos manipulá-las em diferentes fases físicas e podemos alterar sua natureza realizando reações químicas. Um exemplo que, de certa forma, pode ser considerado o estado da arte do domínio da nossa espécie sobre as partes que nos compõem, são os experimentos realizado em um microscópio de tunelamento (Scanning Tunneling Microscope, STM) onde foi possível produzir o menor curta metragem do mundo (o filme A Boy and His Atom, Figura 1).[1]
#acessibilidade: Imagem do quadro do filme em stop-motion A Boy and His Atom feito utilizando STM, manipulando moléculas de CO (monóxido de carbono).
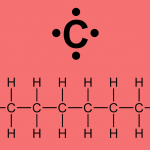
No caso, o experimento realizado por grupos da IBM foi realizado manipulando moléculas de monóxido de carbono, um átomo de carbono ligado a um átomo de oxigênio. Poderíamos citar outro exemplo em que esse tipo de domínio vai além, por exemplo, onde uma molécula mais complexa, como os oligo-(fenileno-1,2-etileno) foram não só visualizados, como foram visualizados os produtos de uma reação química que ocorre com esta molécula quando é submetida a aquecimento.[2]
Estes experimentos com STM, onde pudemos visualizar moléculas foram realizados há pelo menos dez anos, e desde então, evoluímos muito na manipulação de moléculas (e átomos) em diferentes contextos. A técnica de STM foi inventada no início da década de 1980 por Gerd Binnig e Heinrich Röhrer (que ganharam o prêmio Nobel de física em 1986 com Ernest Ruska um dos pioneiros da microscopia eletrônica).[3] Neste tipo de experimento não estamos visualizando as moléculas com luz, mas estamos medindo a corrente elétrica que ocorre entre uma ponta de prova (como se fosse uma ponta de agulha extremamente fina) e a molécula ou superfície de interesse. A corrente elétrica neste caso não é a corrente elétrica ao longo de um fio, mas é a corrente elétrica que ocorre devido ao efeito de tunelamento quântico. Classicamente, uma partícula que encontra uma barreira só podemos ter dois resultados: ou a energia da partícula é grande o suficiente para superar a barreira ou não. Este mesmo problema numa perspectiva da física quântica, onde não teremos uma partícula, mas algo que pode se comportar tanto como partícula quanto como onda (por exemplo, um elétron), pode levar a um resultado diferente: caso a nossa barreira seja fina o suficiente, existe o caso de que mesmo que a energia seja menor que a barreira, poderemos observar que nossa partícula consegue superar a barreira. Este efeito de tunelamento é estritamente quântico (logo o nome de tunelamento quântico), e é através da física quântica que podemos encontrar diversas evidências de que moléculas existem, por exemplo, quando consideramos como as moléculas interagem com a luz. Inclusive, como a luz interage com a matéria foi um ponto que já foi discutido aqui no blog em outros artigos permitindo tanto a determinação da estrutura das moléculas, [4] quanto a sua detecção em outros planetas e estrelas mais distantes.[5]
As provas que moléculas existem mencionadas anteriormente dependem de ideias sofisticadas ou talvez recentes, em relação ao que queremos dizer com molécula. Em outras palavras, estamos construindo nossa ideia em cima de conceitos da mecânica quântica (da década de 1920), da difração de raios-X ou ainda de ligação química (ambos da década de 1910). Por outro lado, discussões da estrutura de moléculas datam de muito antes disso. Por exemplo, a estrutura do benzeno foi proposta por Kekulé em 1872, pelo menos 40 anos antes destes conceitos existirem.[6] Como poderíamos pensar em moléculas, antes da teoria quântica? Poderíamos tentar pensar em conceito primitivo de molécula não correlacionado com a sua estrutura, mas com a sua reatividade, isto é, pensando na combinação das substâncias, gerando novos compostos. Neste caso, novas substâncias eram geradas pelas combinações de outras e estas possibilidades de combinações eram racionalizadas em tabelas de afinidade, como aquela mostrada na imagem destacada.[7] Entretanto, este tipo de tabela mostrava tanto compostos como elementos. A noção de uma molécula como um conjunto de átomos poderia ser construída a partir da hipótese atômica de Dalton e assim teríamos moléculas como sendo compostas por átomos (para ele a menor porção da matéria, cujo o átomo de hidrogênio seria o mais leve).[8] Portanto, uma evidência da existência de moléculas, se estivéssemos no século XVIII, seriam a suas próprias transformações que poderiam ser acompanhadas pelas variações de massa da amostra, ou ainda, pela variação da pressão em um reator usando todas as ferramentas da teoria do estudo de gases (lei de Avogadro, de Boyle, de Gay-Lussac, lei de Charles).[8]
A prova da existência de uma molécula evolui conforme a nossa compreensão do que seria uma molécula. Cronologicamente, poderíamos começar provando que uma molécula existe por portar massa. Posteriormente, poderíamos prova que uma molécula existe através da sua interação, quer seja com a luz, outras moléculas ou as sondas de técnicas microscópicas. Neste ano, o prêmio Nobel de física toca em um aspecto mais profundo das moléculas. Enquanto as provas das moléculas que citamos até agora dependem dos núcleos, as técnicas em faixas de tempo em escalas de atossegundos (uma fatia, de um segundo dividido em 1.000.000.000.000.000.000 de partes) permitem que vejamos a dinâmica dos elétrons um ingrediente crucial das ligações químicas. Este tipo de experimentos, nessa escala de tempo, permite construir um novo tipo de imagem do que é uma molécula, e portanto, quando nós perguntamos “como podemos saber que uma molécula existe?”, podemos responder essa pergunta de uma nova forma.
Fontes:
- IBM. IBM releases world’s smallest movie: atomic-scale memory holds the promise of data storage 100 times greater than current hard disk. Disponível em: https://www.ibm.com/support/pages/node/6166497?mhsrc=ibmsearch_a&mhq=a%20boy%20and%20his%20atom. Dimas G. de Oteyza et al., Direct Imaging of Covalent Bond Structure in Single-Molecule.
- Chemical Reactions.Science, 340,1434-1437(2013).DOI:10.1126/science.1238187.
- The Nobel Prize in Physics 1986. NobelPrize.org. Nobel Prize Outreach AB 2023. Disponível em: https://www.nobelprize.org/prizes/physics/1986/summary/.
- Fabio Furlan. A ciência por trás da kriptonita, do adamantium e do coronavírus. Guia dos Entusiastas da Ciência. V.6, N.4, P.1, 2023. Disponível em: https://gec.proec.ufabc.edu.br/ciencia-pop/a-ciencia-por-tras-da-kriptonita-do-adamantium-e-do-coronavirus/.
- Mónica Benicia Mamián-López. Como sabemos do que são feitas as estrelas e os planetas que estão a anos-luz de nós?. Guia dos Entusiastas da Ciência. V.6, N.6, P.2, 2023. Disponível em: https://gec.proec.ufabc.edu.br/o-que-que-a-ciencia-tem/como-sabemos-do-que-sao-feitas-as-estrelas-e-os-planetas-que-estao-a-anos-luz-de-nos/.
- Alan J. Rocke. It Began with a Daydream: The 150th Anniversary of the Kekulé Benzene Structure. Angewandte Chemie. 54, 1, 46-50 (2015). DOI: 10.1002/anie.201408034.
- Geoffroy’s Affinity Table (1718). Disponível em: https://en.wikipedia.org/wiki/Chemical_ affinity#/media/File:Affinity-table.jpg. Direitos – Copyright: Public Domain.
- P. Atkins & L. Jones. Princípios de Química. 3a ed. Porto Alegre. Bookman. 2006.
Para saber mais:
Para assistir A Boy and His Atom. Disponível em: https://www.youtube.com/watch?v=oSCX78-8-q0.
Outros divulgadores:
History of molecular theory. Disponível em: https://en.wikipedia.org/wiki/History_of_molecular_ theory.