#acessibilidade: na imagem em destaque há, no centro, uma ilustração de um átomo. Em torno dele há desenhos de pessoas flutuando. Os desenhos estão com as dimensões fora de proporção, com o átomo maior que as pessoas, o que não condiz com a realidade, sendo apenas ilustrativo.
Texto escrito pelo colaborador Artur Franz Keppler
Tudo o que você vê ou toca é feito de átomos. Foi o que o Marcelo Leigui nos apresentou no incrível artigo “A estrutura da matéria”.
Porém, falta um elo para fechar essa história, que fala sobre o Universo, sobre tudo e sobre o todo. Este elo é uma força que consegue dobrar a matéria e dar tridimensionalidade ao nosso Universo. Mas tem algo mais surpreendente: além de deixar tudo tridimensional, esta força permite que você flutue.
Um barco, um Iceberg e uma boa parcela dos seres humanos conseguem manter parte da sua estrutura acima da superfície água. Isso é boiar. Flutuar é planar acima da matéria, sem jamais tocá-la. Caso você consiga boiar na água, saiba que você também pode flutuar sobre a água. Ou sobre qualquer superfície. Seja de pé, deitado de lado na cama ou sentado em uma cadeira. Não acredita?
Bora então fazer um teste rápido:
- Foque sua atenção na tela. Apenas na leitura do texto. Não se distraia.
- Prenda a respiração e conte mentalmente comigo: um, dois, três. Pronto! VOCÊ ESTÁ FLUTUANDO.
- Sentiu algo? Não?
Então pisque as pálpebras duas vezes e olhe para baixo. - Notou algo? Não?
Acredite, você está flutuando neste exato momento.
Quero te informar que você já estava flutuando antes de iniciar a contagem.
Isso não é um super poder nem truque de mágica. A força que te permite flutuar por aí é a repulsão de cargas.
Você deve se lembrar que existe uma lei na natureza que nos diz que cargas com o mesmo sinal se repelem. Essa lei pode ser observada em objetos macroscópicos, como ímãs. Da mesma maneira, ela se aplica a partículas atômicas. Como não somos feitos de imãs e sim de átomos, recordemo-nos rapidamente que todos os átomos da tabela periódica contém um núcleo, com prótons e nêutrons, circundado por elétrons em espaços muito bem definidos, denominados orbitais atômicos. Os orbitais atômicos são estados quânticos, ou seja, representam uma região de espaço onde os elétrons têm uma energia que é um múltiplo inteiro de um valor mínimo (o quanta de energia). Portanto, cada elétron poderá ser encontrado em uma região limitada do espaço e, dessa forma, não podem ficar transitando com total liberdade. Hipoteticamente, imagine o encontro de dois átomos não quantizados: todos os seus elétrons poderiam interagir e se repelir descontroladamente, como uma bola branca abrindo um jogo de sinuca. Elétrons para todos os lados. Núcleo com carga positiva descoberto. Uma confusão. O Universo seria uma sopa de núcleos atômicos carregados positivamente, com elétrons assustados, uns fugindo dos outros. Não teríamos ligação química, não teríamos moléculas, não teríamos vida.
A maioria dos átomos são instáveis isoladamente; são espécies de alta energia. Para se estabilizarem, os átomos fazem ligações químicas. As ligações químicas nada mais são do que a superposição dos orbitais atômicos, que geram uma nova região quantizada, denominada orbitais moleculares.
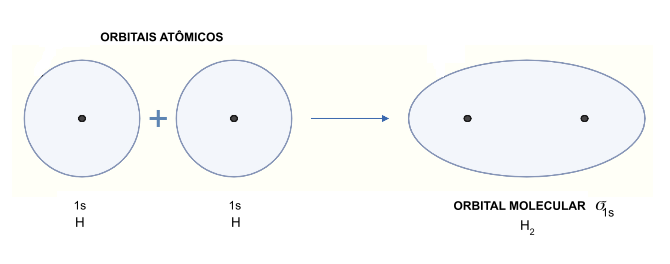
Figura 1: Combinação linear de orbitais atômicos 1s de átomos de hidrogênio, levando a um orbital molecular σs. O orbital molecular é o espaço internuclear onde poderemos encontrar elétrons, portanto, onde se dá a ligação química. #Acessibilidade: ao lado esquerdo há a representação de dois orbitais atômicos do hidrogênio com seu núcleo atômico ao centro de cada orbital. São chamados de 1s. Entre eles há um sinal de “mais”, indicando que ambos serão sobrepostos e irão formar um orbital molecular, representado à direita. O orbital molecular é oval e contém dois núcleos em seu centro, sendo a molécula H2. Abaixo do orbital molecular indica-se o seu nome: sigma 1s.
Quando a superposição entre os orbitais atômicos é assimétrica, ou seja, quando os elétrons tendem a ocupar uma região mais próxima de um dos átomos, a ligação química é chamada de iônica. Quando essa superposição é próxima de simétrica, a ligação química é dita covalente. É importante ressaltar que nem todos e nem qualquer elétron pode fazer uma ligação química. Apesar de todos os elétrons serem idênticos essencialmente, como eu disse anteriormente, cada um está em um nível energético e a uma distância média do núcleo que os tornam entidades eletronicamente diferentes. Dessa forma, apenas os elétrons que estão em níveis mais externos podem fazer uma ligação. Esses elétrons periféricos são chamados de elétrons de valência. Os outros são os elétrons do core (ou elétrons do caroço) e não participam de ligações. Sua função é estabilizar a carga positiva do núcleo.
Ufa! Tudo bem até aqui? Respire e vamos lá…
Não detalharemos aqui ligações químicas, porém, é importante ressaltar que são os orbitais atômicos onde estão localizados os elétrons de valência que interagem entre si, para formar os orbitais moleculares e, dessa forma, as moléculas. E são os elétrons da periferia dos átomos e de todas as moléculas que interagem com o ambiente ao seu entorno e assim, governam o universo, ou pelo menos as propriedades químicas, ópticas e eletrônicas. Depois de tudo isso, devemos ter em mente que independentemente das suas localizações, os elétrons continuam se repelindo.
Muito bem, falamos de repulsão eletrônica e definimos um espaço interatômico onde os elétrons podem ser encontrados. E aí, como isso se conecta com tridimensionalidade e flutuação?
Calma… hoje foi dia de relembrar muitas coisas. Semana que vem continuaremos nossa viagem. Procure seus óculos 3D e prepare-se!