#acessibilidade: centro da tabela periódica reclinado]
Texto escrito em colaboração com Paula Homem de Mello
Quando ouvimos a palavra química, uma das primeiras coisas que vem à nossa mente é a Tabela Periódica dos Elementos. Mais do que uma representação dos elementos que conhecemos, a Tabela Periódica consolida grande parte de nosso conhecimento na área de química. A Tabela Periódica pode ser utilizada para prever reações químicas, interpretar as tendências de propriedades periódicas entre elementos distintos, além de especular sobre as propriedades dos elementos ainda a serem descobertos. Isto é possível porque na Tabela Periódica que utilizamos os elementos estão arranjados de acordo com sua estrutura eletrônica, ou dito de outra forma, as propriedades físicas dos elementos exibem uma dependência periódica que depende de seu número atômico. Ocorre que nem sempre foi assim. Historicamente, diferentes formas de arranjo foram tentadas, com o intuito de auxiliar na previsão do comportamento químico dos elementos. Neste texto, abordamos algumas dessas tentativas.
As análises conceituais mais antigas que se tem notícia no que se refere a matéria e suas transformações estão relacionadas à tradição Aristotélica1. Para Aristóteles, os elementos fogo, água, ar e terra eram os blocos fundamentais de todas as substâncias. Além disso, pode-se dizer que Aristóteles lançou as bases filosóficas para toda a discussão subsequente referente aos elementos, substâncias puras e combinações químicas. Uma discussão muito interessante sobre a Filosofia da Química está disponível aqui.
Na segunda metade do século XVI, Lavoisier estabeleceu os marcos do que hoje chamamos de química moderna em seu livro Traité Élémentaire de Chimie (clique para ver uma edição de 1789 do texto). Dentre outros feitos, ele publicou uma lista de 33 elementos (que ele chamava de “substâncias simples”) e dividiu os elementos em metais e não metais. Apesar de sua lista incluir o calórico e a luz, que hoje sabemos que não são elementos químicos, coube a Lavoisier definir um elemento químico como uma substância cuja menor unidade não pode ser dividida em substâncias mais simples.
Uma das primeiras tentativas de organizar os elementos em alguma sequência aparece em 1829, no trabalho de J. W. Döbereiner Versuch zu einer Gruppirung der elementaren Stoffe nach ihrer Analogie, de 1829. Neste trabalho, Döbereiner sugere que os elementos conhecidos poderiam ser arranjados por sua similaridade em grupos de três, aos quais chamou de tríades. Em tríades, como a formada pelos elementos lítio, sódio e potássio, ordenados por suas massas atômicas, as propriedades do segundo elemento podem ser extrapoladas a partir das propriedades do primeiro e terceiro elementos. Por exemplo, lítio, sódio e potássio reagem com a água de forma fraca, moderada e violenta, respectivamente. Além disso, Döbereiner mostrou que a massa atômica do segundo elemento está próximo da média das massas do primeiro e terceiro elementos. O trabalho pioneiro de Döbereiner certamente contribuiu para que outros pesquisadores buscassem outros tipos de correlação entre os elementos conhecidos.
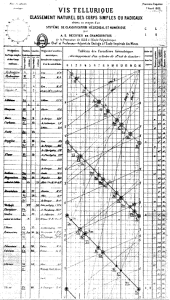
Uma das primeiras tentativas de ordenar os elementos químicos por sua massa atômica foi publicada em Tableau du classement naturel des corps simples, dit vis tellurique, em 1862, por Alexandre-Emile Béguyer de Chancourtoi no Comptes rendus de l’Académie des Sciences 55: 600–601. Este cientista posicionou os elementos em ordem crescente de massa atômica ao longo de uma espiral inscrita na superfície de um cilindro com inclinação de 45 graus em relação à base. A primeira volta completa da espiral coincide com o elemento oxigênio e a segunda volta com o enxofre. Elementos alinhados verticalmente na superfície do cilindro tendem a apresentar propriedades similares, de forma que o ordenamento proposto consegue capturar alguns dos padrões que hoje observamos na Tabela Periódica dos Elementos. Apesar de inovador, o trabalho de de Chancourtois teve pouco impacto. Além de basear-se em um arranjo bastante complexo, seu trabalho original não incluía um diagrama e nem apresentava as similaridades químicas de forma clara.
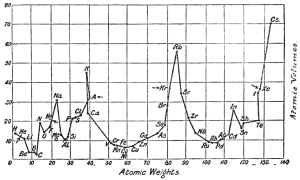
Em contrapartida, Lothar Meyer apresenta claramente a periodicidade das sequências de similaridades das propriedades físicas e químicas de acordo com a massa atômica dos elementos em seu trabalho de 1864 intitulado Di modernen Theorien der Cheme und ihre Bedeutung für die chemische Static. As similaridades de sua tabela periódica original (Figura 2 à esquerda) fica mais clara na representação esquemática que contém a massa atômica no eixo X e o volume atômico no eixo Y, publicada alguns anos depois (Figura 2 à direita).
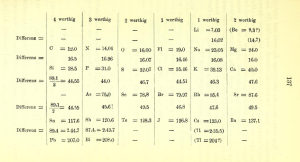
Também em 1864, John Newland notou similaridades entre os elementos com massas atômicas diferindo por sete ou algum múltiplo de sete. Ele chamou essa propriedade de Lei das Oitavas. Os gases nobres não eram então conhecidos, explicando a razão da periodicidade 7 e não 8 na tabela de Newsland, reproduzida na Figura 3.

Em 1869, de forma independente, Lothar Meyer e Dmitri Mendeleev trabalharam no que hoje são consideradas as primeiras versões da Tabela Periódica dos Elementos. Atualmente, parece haver consenso de que a publicação de Mendeleev ocorreu primeiro (ver, por exemplo, o trabalho de Gregory S. Girolami and Vera V. Mainz). De fato, a primeira apresentação pública da Tabela Periódica de Mendeleev não foi feita por ele, mas sim pelo então secretário da Sociedade Russa de Química, Nicolai Menshutikin. , em reunião de 6 de março, conforme relatado por Vladimir D. Shiltsev e Elizaveta V. Shiltseva.
O trabalho de Mendeleev baseou-se na observação de padrões nas propriedades e massas atômicas dos elementos, especialmente nas séries Cl-K-Ca , Br-/Rb-Sr e I-Cs-Ba. Em uma tentativa de estender esses padrões a outros elementos, ele criou cartões contendo o símbolo, massa atômica e propriedades físico-químicas de 63 elementos conhecidos. Mendeleev arranjou esses cartões em ordem ascendente de massa atômica, agrupando elementos com propriedades similares, formando a tabela que conhecemos. A vantagem da nova tabela sobre as tentativas anteriores reside principalmente no fato de que as similaridades não ocorrem apenas em pequenos grupos, como no caso das tríades, mas estendem-se por toda a rede, verticalmente, horizontalmente e nas diagonais. Mendeleev também foi brilhante ao deixar lacunas para elementos desconhecidos. Ele chegou a prever a existência de vários elementos, aos quais chamou de eka-aluminum, eka-silicon, eka-boron, eka-manganese etc. Aqui eka não significa nojinho, hein? Mas sim, “o que vem depois”, ou seja, elementos que viriram depois do alumínio, silício, boro e assim por diante. Suas previsões mostraram-se extremamente precisas. O eka-aluminium, por exemplo, é hoje conhecido como Gálio e apresenta propriedades muito similares às previstas por Mendeleev.


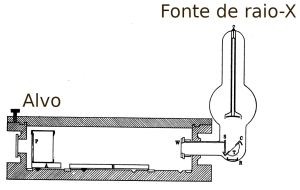
Apesar de sua utilidade, a Tabela Periódica desenvolvida por Mendeleev baseava-se inteiramente em observações empíricas. Apenas em 1913, através da análise do bombardeio e emissão de raios-X por diferentes elementos químicos, H. G. J. Moseley em trabalho intitulado The High-Frequency Spectra of the Elements. Part II, determinou que o fundamento por trás da ordenação dos elementos era o número atômico e não a massa atômica. O experimento de Moseley demonstrou que o posicionamento de cada elemento na série deveria ocorrer por seu número atômico, ou seja, pelo número de cargas positivas (prótons) em seu núcleo. Assim, o Argônio, por exemplo, apesar de ter massa atômica maior do que o Potássio (39,9 u.m.a contra 39,1, respectivamente) aparece primeiro na Tabela Periódica por conta de suas propriedades físico-químicas. Este decorre da análise de frequências dos raios-X emitidos pelos dois materiais: Moseley notou que o número atômico do Argônio é 18, enquanto que do Potássio é 19, indicando que o posicionamento deles na Tabela Periódica está correto. Assim como Mendeleev, Moseley notou lacunas e previu a existência de três novos elementos, sendo um deles o tecnécio (Z = 43), descoberto apenas em 1943.

Hoje, nas escolas, muitos aprendem diversas musiquinhas para guardar na memória a ordem dos elementos químicos na Tabela Periódica, como Hoje Li Na Kama Robson Crusoé Francês para decorar a primeira família. Mas isso não deveria ser necessário. Veja, a beleza da Tabela Periódica consiste justamente de organizar os elementos por ordem crescente de número atômico. Embora Mendeleev e seus antecessores nem imaginassem como um átomo é organizado (não conheciam a estrutura atômica), as propriedades macroscópicas dependem dessa estrutura. Então, essa linda Tabela foi feita para ser consultada, compreendida e admirada, não decorada! Inclusive, para facilitar essa observação, na UFABC contamos com uma Tabela Periódica gigante, venha nos visitar!
![]()
Quer fazer seu nome com elementos da Tabela Periódica? Faça como fizemos acima em https://www.lmntology.com/nameAsElementsWhite.php. Se não tiver um elemento para todas as letras do seu nome, o site inventa novos elementos com propriedades super engraçadas!
-
especialmente em suas obras De Generatione et Corruptione, Meteorologica, e em partes de Physica e De Caelo (clique para ver traduções para o inglês destas obras)
Fontes:
Fonte da imagem destacada: Elchinator por Pixabay
Di modernen Theorien der Cheme und ihre Bedeutung für die chemische Static
DÖBEREINER, Johann Wolfgang. Versuch zu einer Gruppirung der elementaren Stoffe nach ihrer Analogie. Annalen der physik, v. 91, n. 2, p. 301-307, 1829.
LXXX. The High-Frequency Spectra of the Elements.
Para saber mais:
CienciON#14: 2019 – O Ano da Tabela Periódica
Um site muito interessante para acessar diversas propriedades dos elementos é https://www.webelements.com/