#acessibilidade: No fundo em preto e branco, e levemente desfocado há uma bancada de laboratório com vidrarias e uma janela ampla. No primeiro plano se observam dois béqueres com líquidos rosa e verde, virados de tal forma que os líquidos fluem e caem.
Texto por Mónica M. B. López e Vitor H. Paschoal
Existem diversas receitas de drinks em que são misturados uma bebida alcoólica e um suco a base de água. O que raramente reparamos, é que a soma dos líquidos pode ser menor que o volume de cada um antes da mistura. Aqui, 1+1 pode ser menor que 2! Calma, o barman não está te enganando! Algumas misturas de líquidos podem apresentar esse efeito diferentão.
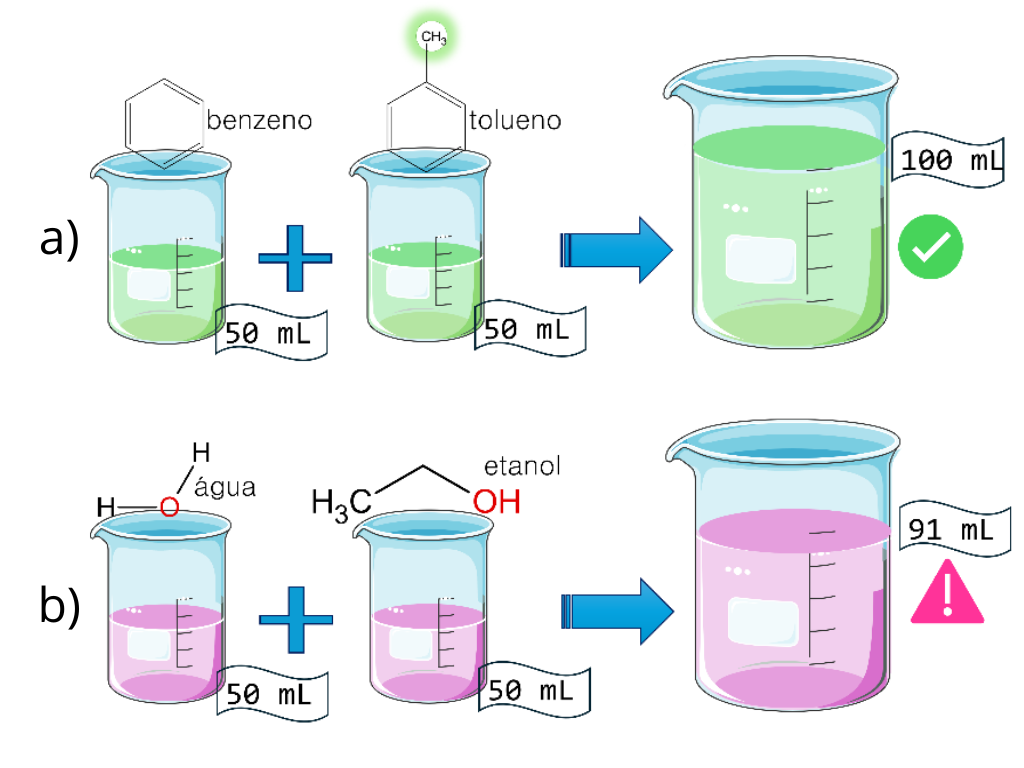
Um experimento simples, que pode ser realizado pelo leitor envolvendo a mistura de líquidos de fácil acesso. Se misturarmos 50 mL de água com 50 mL de água, teremos 100 mL de água, como esperado. Similarmente, se misturarmos 50 mL de etanol com 50 mL de etanol (álcool etílico), também teremos 100 mL de etanol. Até aí, tudo bem. E se misturarmos 50 mL de água com 50 mL de etanol? Idealmente (sendo ideal a palavra-chave), obteríamos 100 mL, certo? Entretanto, observamos um valor menor que esse.
Poderíamos repetir esse experimento em condições mais controladas misturando água ultrapura e etanol de alta pureza, numa temperatura fixa. Se misturamos 50 mL de cada, obtemos apenas cerca de 91 mL! O que aconteceu com o restante da solução?
Bom vamos fazer o experimento de outra forma para avaliar melhor. Ao invés de medirmos volumes, poderíamos medir densidades (massa por unidade de volume) de tal forma que poderíamos determinar com uma balança a massa de etanol e água que serão misturados, e ao final, medirmos a densidade da mistura (que é dividir a massa que pesamos na balança pelo volume do líquido). Poderíamos também usar um equipamento chamado de densímetro. [1] Neste caso, 50 g de etanol mais 50 g de água, resultam em 100 g de solução. Ao mesmo tempo, dadas as densidades destes líquidos, deveríamos obter um volume final de aproximadamente 114 mL. Porém, no nosso experimento, o volume real observado é menor, cerca de 91 mL.
Um outro caso, uma mistura de 50 mL de benzeno com 50 mL de tolueno, que deveria resultar em 100 mL de solução, de fato resulta em uma mistura de 100 mL, o que seria um comportamento ideal. No caso da mistura de água e etanol, e muitas outras soluções que podemos encontrar no dia a dia, observamos comportamentos não ideais que desafiam a nossa intuição. Também podemos encontrar exemplos onde o volume final é maior que o volume inicial, como no caso de misturas de metanol e ciclohexano.[2]
Quando comparamos, no caso do volume esperado e o volume obtido para este último sistema, um volume em excesso, enquanto no caso da mistura etanol-água esse volume em excesso é negativo. Desta forma, podemos observar três comportamentos típicos: o ideal (benzeno – tolueno) com volume em excesso zero, e dois casos não-ideais em que o volume em excesso pode ser positivo (metanol – ciclohexano) ou negativo (água – etanol). O volume é apenas uma das propriedades que podem ser medidas que exibem tal desvio da idealidade, poderíamos medir os calores envolvidos no processo ou a expansividade térmica da amostra, para citar alguns exemplos.
Além do que podemos medir, é interessante refletir quanto à origem desse efeito. É a interação entre as moléculas dos líquidos que faz com que os volumes de algumas misturas sejam diferentes do esperado. Óleo e água, por exemplo, não se misturam, então quando colocamos os dois juntos, é só aguardar que eles se separam em duas fases. Então o volume que colocamos no início de cada um, no final, teremos a soma dos dois. Mas moléculas como o benzeno e o tolueno são muito similares, diferindo apenas por uma metila (ver figura 1a). Desta forma, é esperado que estas moléculas se organizem e interajam de forma muito similar entre si, ou seja, esperamos que o seu comportamento seja mais similar a quando colocamos água em água (ou etanol em etanol).
Quando fazemos misturas etanol-água ou ciclohexano-metanol, temos moléculas que são diferentes entre si o suficiente para esperarmos um comportamento diverso. Especificamente no que diz respeito aos tipos de interações intermoleculares disponíveis, a cadeia carbônica do etanol bagunça a rede de ligações de hidrogênio da água e novas interações se formam entre água e etanol, de forma que o volume final é menor do que o esperado. No caso do ciclohexano, esta molécula apolar, não consegue interagir adequadamente com o metanol e o volume resultante da mistura é maior.
Então, veja que incrível, só de misturar diferentes líquidos, sabemos como as moléculas interagem entre si. Ou seja, o que observamos com a medida de volume é uma manifestação macroscópica de interações entre essas entidades que não conseguimos enxergar nem com microscópio, as moléculas.
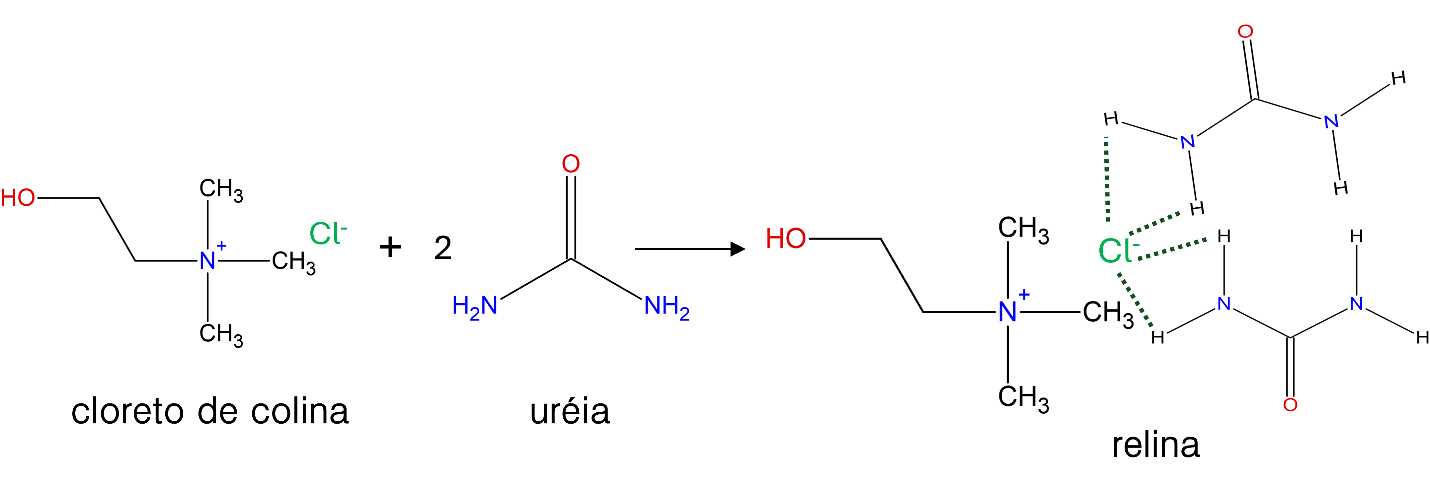
Outro exemplo um pouco mais radical deste tipo de manifestação é se tivéssemos uma mudança de estado físico da amostra. Normalmente, esperamos que após misturarmos dois sólidos ao final seja obtido um novo sólido. Porém, existem casos em que há uma diminuição expressiva do ponto de fusão. Um exemplo disto é o caso da relina, formada pela mistura de cloreto de colina (ponto de fusão de 302 °C) e ureia (ponto de fusão 133 °C) na proporção de 1 para 2 mols. Neste caso, a mistura destes dois sólidos resulta em um líquido com a temperatura de fusão de cerca de 12 graus, ou seja, líquido a temperatura ambiente. Este líquido, e muitos outros similares, dão origem a uma nova classe de solventes, os chamados solventes eutéticos profundos (Deep Eutectic Solvents, DES).[3]
Os DES são formados pela mistura componentes sólidos não miscíveis (portanto um sistema heterogêneo), que geram uma nova fase, agora com ponto de fusão mais baixo (até mesmo mais baixo que a previsão teórica para uma mistura ideal). Neste caso, não muito diferentemente das misturas não-ideais, as interações intermoleculares têm um papel importante em tornar essa mistura heterogênea de sólidos em uma mistura homogênea líquida. Especificamente, na relina observamos uma competição pela rede de ligação de hidrogênio entre os íons de colina e a molécula de ureia (linhas tracejadas na figura 2).
E falando em DES, você sabia que este tipo de líquidos é atualmente de grande interesse para a comunidade científica e a indústria no geral? Isto devido à sua grande potencialidade como solventes customizáveis, ambientalmente amigáveis, não inflamáveis, de baixa toxicidade e com possibilidade de serem recuperados e reutilizados. A alta versatilidade dos DES vai da remoção de contaminantes de óleos e combustíveis, até o uso em processos de eletrodeposição de metais para recobrimento de superfícies e, recentemente na obtenção de nanomateriais.[4] O que é mais interessante é que grande parte dessas vantagens é devida à manipulação das interações intermoleculares dos seus componentes.
Fontes:
1 – a. J.-P.E. Grolier, Emmerich Wilhelm. Excess volumes and excess heat capacities of water + ethanol at 298.15 K. Fluid Phase Equilibria v. 6, Issues 3–4, p. 283-287. 1981. DOI: 10.1016/0378-3812(81)85011-X. b. Tandy Grubbs. Bartender’s Conundrum – Partial Molar Volume in Water-Ethanol Mixtures. LibreTexts Chemistry. Disponível em: https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Exercises%3A_Physical_and_Theoretical_Chemistry/Data-Driven_Exercises/Bartender’s_Co nundrum_-_Partial_Molar_Volume_in_Water-Ethanol_Mixtures. Acessado em: 21/04/2025. c. The Engineering ToolBox (2019). Ethanol Water Mixtures – Densities vs. Temperature. [online] Disponível em: https://www.engineeringtoolbox.com/ethanol-water-mixture-density-d_2162.html Acessado em 21/04/2025.
2 – R. Srivastava, B. D. Smith. Evaluation of Binary Excess Volume Data for the Methanol+Hydrocarbon Systems Journal of Physical Chemistry Reference Data vol. 16, No.2, 1987. DOI: 10.1063/1.555780
3 – L.S. Longo Jr., M. V. Craveiro. Deep Eutectic Solvents as Unconventional Media for Multicomponent Reactions. Journal of the Brazilian Chemical Society, 29(10), 1999–2025. 2018 DOI: 10.21577/0103-5053.20180147
4 – E. Smith; A. Abbott; e K. Ryder. Deep Eutectic Solvents (DESs) and Their Applications. Chemical Reviews, 114, 11060-11082. 2014. DOI: 10.1021/cr300162p
Fonte das imagens: Imagens construídas com Canva, Chemix e Bioicons.
Para saber mais:
Vídeo ilustrando misturas de etanol e água: https://www.youtube.com/watch?v=QNJyyVwzYMY
Aplicação de DES em remediação ambiental e reciclagem: http://phys.org/news/2018-09-deep-eutectic-solvents-polluting-industrial.html https://phys.org/news/2024-05-sustainable-methods-dissolving-gold-silver.html




