#acessibilidade Esboço da tabela periódica de Mendeleev, com título, descrição e assinatura no alfabeto cirílico e os símbolos dos elementos agrupados em linhas e colunas com seus respectivos pesos ao lado. Em alguns casos, em especial 45, 68 e 70, há pontos de interrogação no lugar do símbolo do elemento, pois tais elementos ainda não eram conhecidos.
Texto escrito pela colaboradora Patrícia Dantoni
em colaboração com Paula Homem de Mello
A UNESCO (em português, a sigla significa Organização das Nações Unidas para a Educação, Ciência e Cultura) proclamou o ano de 2019 como o Ano Internacional da Tabela Periódica. Há 150 anos, em 1869, o russo Dimitri Ivanovich Mendeleev apresentou uma Tabela contendo os 63 Elementos Químicos descobertos até então e os organizou de acordo com a sua massa atômica — há época, se falava em peso atômico. O que ele fez foi apresentar a Lei Periódica. Ao organizar os elementos em uma Tabela, ele tomou o cuidado de deixar várias lacunas, para elementos que ainda seriam descobertos e, de fato, o foram.
Muitos dizem que Mendeleev “descobriu a Tabela Periódica” porque ele baseou-se em princípios científicos conhecidos até então, para organizar os Elementos Químicos em uma Tabela, mas o que sempre causa surpresa é que a Mecânica Quântica — teoria fundamental para entender a estrutura da matéria e uma das mais confirmadas de todos os tempos, em parceria com a Teoria Cinética dos Gases — ainda não havia sido elaborada!
Mendeleev concebeu a Lei Periódica e organizou os Elementos Químicos antes do elétron ser descoberto por J. J. Thomson, em 1897. O átomo de Rutherford — aquele conhecido como o modelo planetário — só seria apresentado em 1909. Aliás, Mendeleev nem acreditava nos elétrons, ele achava que o átomo era indivisível…
Até Mendeleev, foram várias as tentativas de organizar os Elementos Químicos conhecidos. Em 1829, J. W. Döbereiner elaborou a Lei das Tríades, ao observar que alguns elementos continham as mesmas características e podiam ser agrupados, como o grupo Lítio, Sódio e Potássio e o grupo Cloro, Bromo e Iodo. Em 1843, L. Gmelin escreveu um Handbook de Química apresentando, entre outros dados químicos, dez tríades, três tétrades e uma pêntade, esta última é o atual Grupo 15 da Tabela Periódica moderna.
Em 1858, S. Cannizzaro confirmou a Lei de Avogadro — aquela que afirma que o mesmo volume de qualquer gás apresenta o mesmo número de moléculas, porém massas diferentes — ao afirmar que o oxigênio era dezesseis vezes mais pesado que o hidrogênio. Como o hidrogênio tinha “peso atômico” 1, o oxigênio teria 16. Em 1860, ele apresentou seu trabalho no Primeiro Congresso Internacional de Química cujo teor foi prontamente aceito pela comunidade. Muitos dos participantes do Congresso fizeram cópias de seu trabalho. Entre eles, estava quem? Dmitri Mendeleev… 😉
Porém a primeira tentativa de organizar os Elementos Químicos em ordem crescente de peso atômico se deu em 1862. A.E.B. de Chancourtouis organizou os Elementos em espiral, com isso, ele percebeu a natureza periódica dos Elementos Químicos. Depois de Chancourtois, outros cientistas continuaram na busca de encontrar uma forma de organizar os Elementos Químicos, até que em 1869, um certo químico russo, ainda desconhecido, produziu a primeira Tabela Periódica dos Elementos. Conta a história que ele jogava paciência, um jogo de cartas, em suas viagens e teve a ideia de escrever um cartão para cada elemento químico com suas propriedades físicas e químicas — como ponto de ebulição, densidade e formação de óxidos. Ao espalhar esses cartões sobre a mesa, surgiu a ideia de organizá-los em ordem crescente de pesos atômicos.
Adicionalmente, Mendeleev deixou espaços em branco na Tabela para elementos que estavam abaixo do Boro, Alumínio e Silício. Estes novos elementos não haviam sido descobertos, porém, ele previu algumas de suas propriedades físicas e químicas e os denominou de eca-boro, eca-alumínio e eca-silício. “Eca”, neste caso, não se refere a nada nojento, provem de um prefixo do sânscrito eka, significando que o elemento se encaixaria logo abaixo do outro na tabela. Essas vacâncias foram de importância fundamental para a confirmação da Lei Periódica. Veja só, em 1875, P.E.L. de Boisbaudran descobriu o Gálio (eca-alumínio); em 1879, L.F. Nilson descobriu o eca-boro (escândio – que na atual tabela periódica não está logo abaixo do boro) e, pasme, apenas em 1886 Clemens Winkler descobriu o Germânio (eca-silício).
A intuição química de Mendeleev foi notável. Ele “simplesmente” não arranjou os Elementos Químicos em ordem crescente para formar uma tabela, ele conseguiu perceber as semelhanças entre eles e os ajustou em uma tabela.
A Tabela de Mendeleev continha oito colunas, que ele chamou de Famílias, numeradas em algarismos Romanos e subdivididas em colunas A e B. Na Tabela original, não havia espaço para os Gases Nobres (Hélio, Neônio, Argônio, Criptônio, Xenônio, Radônio e Oganesson), mas, décadas depois, quando estes começaram a ser descobertos, ou ter sua existência confirmada, não houve problema em inseri-los na Tabela. Relembrando, os Elementos contidos em uma coluna apresentavam propriedades químicas e físicas semelhantes e em 1869, o modelo atômico vigente era o modelo de Dalton.
Após a publicação do trabalho de Mendeleev, centenas de outros modelos de Tabelas Periódicas foram propostos. Mas, foi só após a descoberta da radioatividade, evento fundamental para se descobrir a existência do núcleo atômico, carregado positivamente, que os Elementos Químicos passaram a ser ordenados por ordem de número atômico — que é o número de prótons que há no núcleo atômico. Foi H.G.J. Moseley que concebeu o conceito de número atômico. Com isto, houve alterações na ordenação de alguns elementos, mas o modelo de Mendeleev como um todo, se manteve.
Mas você já deve ter percebido que a Tabela Periódica contém duas linhas de Elementos que estão fora dela, não? Nem sempre foi assim. Até 1941, os Elementos Tório, Protactínio, Urânio, Netúnio e Plutônio estavam na Tabela, no sétimo período. Foi G. Seaborg que propôs a reorganização daqueles Elementos em uma nova série completa de Elementos, os Actinóides. A série dos Lantanóides já existia.
Pois bem, após a consolidação da Mecânica Quântica e tendo como modelo atômico o Modelo Padrão, a organização dos Elementos Químicos, que já era bastante coerente, foi elucidada.
Também foram propostos modelos em espiral para organizar os Elementos Químicos, o de 2004, de P.J. Stewart é elegante e foi até aprimorado, pelo próprio autor, em 2007, todavia, em nosso ponto de vista, ele não é tão intuitivo como a matriz de Mendeleev.

#acessibilidade “Galáxia química”, modelo proposto por Stewart em que os elementos estão distribuídos em forma de espiral em ordem de número atômico.
Veja só, os Elementos contidos em uma mesma coluna — que hoje conhecemos como Grupos — contêm o mesmo número de elétrons em sua camada de valência (mais externa), já os contidos em uma mesma linha, que são os períodos – contêm o mesmo número de níveis de energia. Eles estão distribuídos em 18 Grupos, numerados de 1 a 18, e sete períodos. Atualmente, o sétimo período está completo, com a recente descoberta do Elemento Químico Oganesson. Por fim, a organização dos Elementos segue, rigorosamente, o que propõe a Mecânica Quântica acerca da Estrutura da Matéria sobre a distribuição dos elétrons em um átomo, ao redor do seu núcleo.
Por fim, onde estão os Elementos Químicos? Na Tabela Periódica? Não! Os Elementos Químicos estão em você, nas coisas ao seu redor, por todo o Universo! A Tabela Periódica de Mendeleev os reúne, por afinidade, de forma espetacular, permitindo que conheçamos as suas propriedades só de conhecer a sua localização. Fantástico, não?
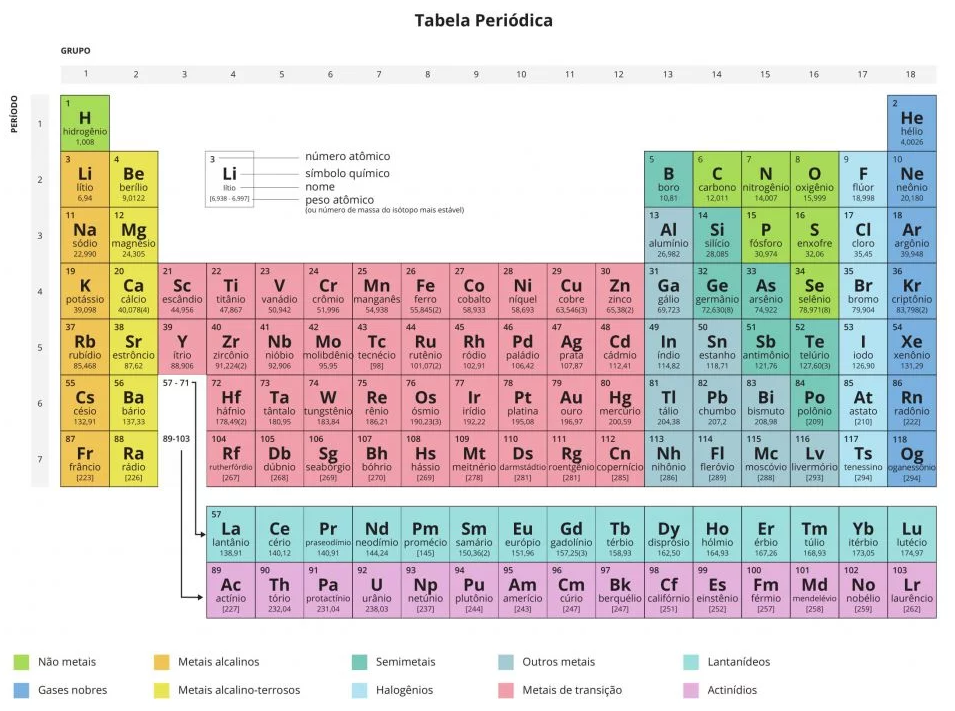
#acessibilidade Tabela Periódica de 2019.
Fontes:
Fonte da imagem destacada: Sadi Carnot at en.wikipedia [Public domain], via Wikimedia Commons
Fonte da imagem 1: Tsuwal [Public domain], via Wikimedia Commons
Fonte da imagem 2: Rottoni [CC BY-SA 4.0], via Wikimedia Commons
Para saber mais:
Site do ano internacional da química
A tabela periódica atualizada está disponível em no site da IUPAC
Emsley, J., Nature’s Building Blocks. Oxford University Press, 2011.
Stewart, P.J., A new image of the periodic table, Educ. Chem. 41, 156–158, 2004.
Stewart P.J., A century on from Dmitrii Mendeleev: tables and spirals, noble gases and Nobel prizes, Found Chem (2007) 9:235–245.
Dez tabelas periódicas especiais
Diferentes tipos de tabelas periódicas


