#acessibilidade Ilustração que mostra roupas em um varal ao ar livre.
Texto escrito em colaboração com Luis Henrique de Lima e Vanessa K. Verdade
Outro dia, um post irônico no Facebook afirmava: “água evapora a 100 graus, põe no varal a 25 graus e a roupa sai seca em algumas horas. Tem que ser muito mongo para acreditar em química”.
Pois é, não é questão de acreditar, mas de entender os fenômenos envolvidos. Quando a água ferve observamos formação de vapor. Mas será que a evaporação da água só ocorre quando ela ferve? Já explicamos em um post anterior a quantos graus ferve a água.
A temperatura de ebulição, ou seja, do processo de passar da fase líquida para a fase gasosa, depende da pressão. Por isso, quanto maior a altitude, menor a temperatura de ebulição, ou seja, mais fácil as moléculas saem do estado líquido e passam para o estado gasoso. Naquele texto, inclusive, dissemos que, no alto do monte Everest, a água ferve a 72 °C, mas. Mas isso é ainda muito quente se comparado à temperatura ambiente. Então, o que explica a roupa secar no varal?
A transformação de água líquida para vapor não acontece somente quando a água ferve. Todo líquido está em equilíbrio com uma pequena quantidade de vapor, mesmo a baixas temperaturas. Estar “em equilíbrio”, nesse caso, não tem nada a ver com ioga, mas com o fato de algumas moléculas de água conseguirem se soltar da fase líquida e ficar na fase gasosa. Isso é o que chamamos de pressão de vapor.
Para a água passar do estado líquido para o estado gasoso, precisamos fornecer calor. Seja do fogão ou do sol, o calor faz com que as moléculas no líquido se agitem. Quanto mais calor, mais agitação e mais moléculas vão para o vapor. Quando a gente sai do banho molhado, aquele friozinho que a gente sente vem das moléculas de água roubando calor do nosso corpo e virando vapor. Você vai secando e se sentindo refrescado. Funciona assim também com o suor.
Mas por que algumas moléculas da água conseguem se soltar da fase líquida e ficar na fase gasosa? O líquido é composto de um conjunto de moléculas que interagem entre si por forças atrativas. Essas forças são fortes o suficiente para manter as moléculas confinadas no líquido, mas fracas o suficiente para permitir que as moléculas se movam dentro do líquido. O que ocorre é que a velocidade com a qual essas moléculas se movem pelo líquido (e também no vapor) não é a mesma para todas as moléculas. O que temos é uma distribuição contínua de velocidades. Podemos definir uma velocidade média das moléculas e observar que algumas são mais lentas e outras mais rápidas que esse valor médio. As moléculas mais ágeis são aquelas que têm energia suficiente para superar as forças atrativas das moléculas e deixar o líquido por evaporação através da superfície, mesmo em temperaturas bem abaixo do ponto de ebulição! Ao se elevar a temperatura, a velocidade média das moléculas aumenta (agitação) e com isso um número maior de moléculas têm energia cinética para escapar da força de atração (chamadas de ligações de hidrogênio ou, antigamente, de ponte de hidrogênio). Por isso a roupa seca mais rápido em dias mais quentes. E se as moléculas mais velozes escaparam da fase líquida, as que ficaram para trás são aquelas com energia cinética média mais baixa, fazendo com que a temperatura do líquido diminua. A evaporação é um processo de resfriamento e está aí o friozinho que a gente sente quando o suor evapora para provar.
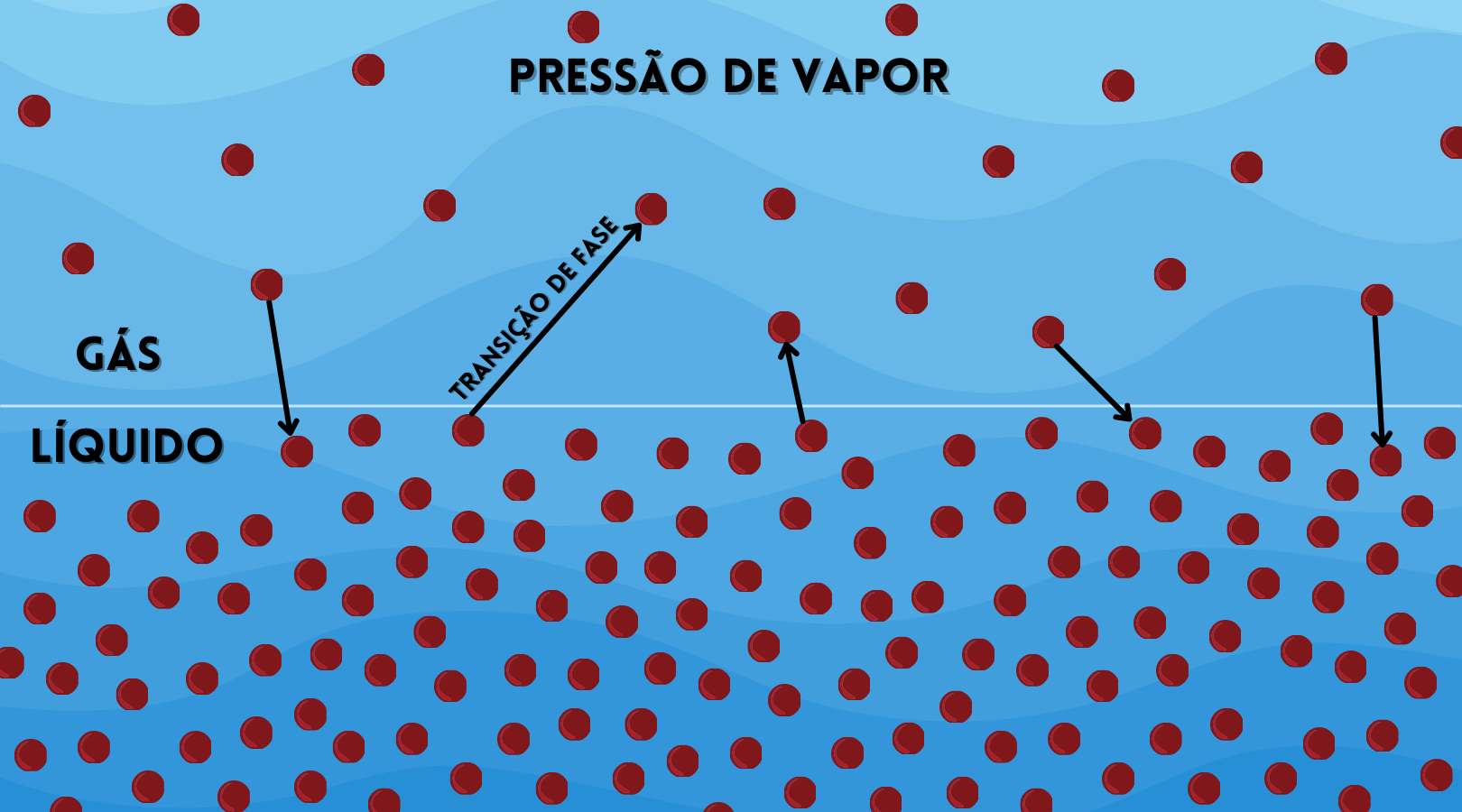
A quantidade de moléculas que conseguirá ir para o vapor vai depender da quantidade de calor fornecido, da pressão atmosférica e da umidade já existente no local. Se a roupa ficar num ambiente aberto, recebendo o calor diretamente do sol, deverá secar mais rápido do que se ficar na sombra. Agora, se a sombra for um telhado preto, que concentra calor, aí seca mais rápido.
Outra coisa que ajuda muito a secar a roupa no ambiente aberto é o vento. Ele leva para longe as moléculas de água que estavam na fase gasosa e mais próximas do tecido, aumentando a taxa de evaporação. Quando o dia está chuvoso, é mais difícil a roupa secar, não é? Isso porque já temos bastante umidade no ambiente, o que faz com que a água que está na roupa continue lá. É por isso também que esticamos a roupa no varal e colocamos cada peça separada uma da outra. Quanto mais espaço entre elas e maior a superfície exposta, maior a evaporação.
Às vezes, porém, não é legal perder tanta água. No ambiente terrestre, evitar a desidratação é um dos problemas mais importantes que os organismos enfrentam. E é muito divertido perceber que as estratégias que surgiram na natureza como resposta a esse problema obedecem às leis da física e da química. Claro! Quer ver? A perda de água por evaporação acontece principalmente por superfícies expostas em contato com o ar. Agora pense numa floresta tropical. As folhas das plantas dessas florestas são bem amplas, certo? E num deserto? Como são as folhas das plantas que vivem no deserto? Na floresta tropical uma folha ampla poderia perder muita água por evaporação, mas você leu acima que a taxa de evaporação diminui se o ar já estiver úmido. Nas florestas tropicais, não falta água. Já num deserto, uma planta de folha ampla murcharia rapidamente. Plantas que vivem em ambientes secos podem não apresentar folhas ou apresentar folhas pequenas, cobertas por ceras e com forma de espinhos. Essas folhas, por apresentarem uma superfície de exposição menor, perdem menos água por evaporação. Funciona tão direitinho que nem é preciso ser especialista para saber se uma planta deve ser plantada na sombra em local úmido ou no Sol. Basta olhar para suas folhas.

#acessibilidade Ilustração que mostra à esquerda um cacto no deserto com um camelo ao fundo e um sol escaldantes, enquanto à direita há jarros com plantas em cima de uma mesa ao ar livre em uma noite chuvosa.
Aliás, as grandes extensões de florestas tropicais têm também um papel muito importante para a formação de chuvas. É a evaporação à temperatura ambiente da água proveniente das folhas das árvores (você já ouviu falar de rios voadores?) além daquela das águas dos rios e mares que se concentram nas nuvens, até que existam as condições favoráveis para a chuva, formando o famoso ciclo da água ou ciclo hidrológico.
Se você gostou muito desse tema, que tal dar uma olhada no diagrama de fases da água? Nesse tipo de diagrama, conseguimos saber em que estado a água se encontra para qualquer temperatura e pressão.
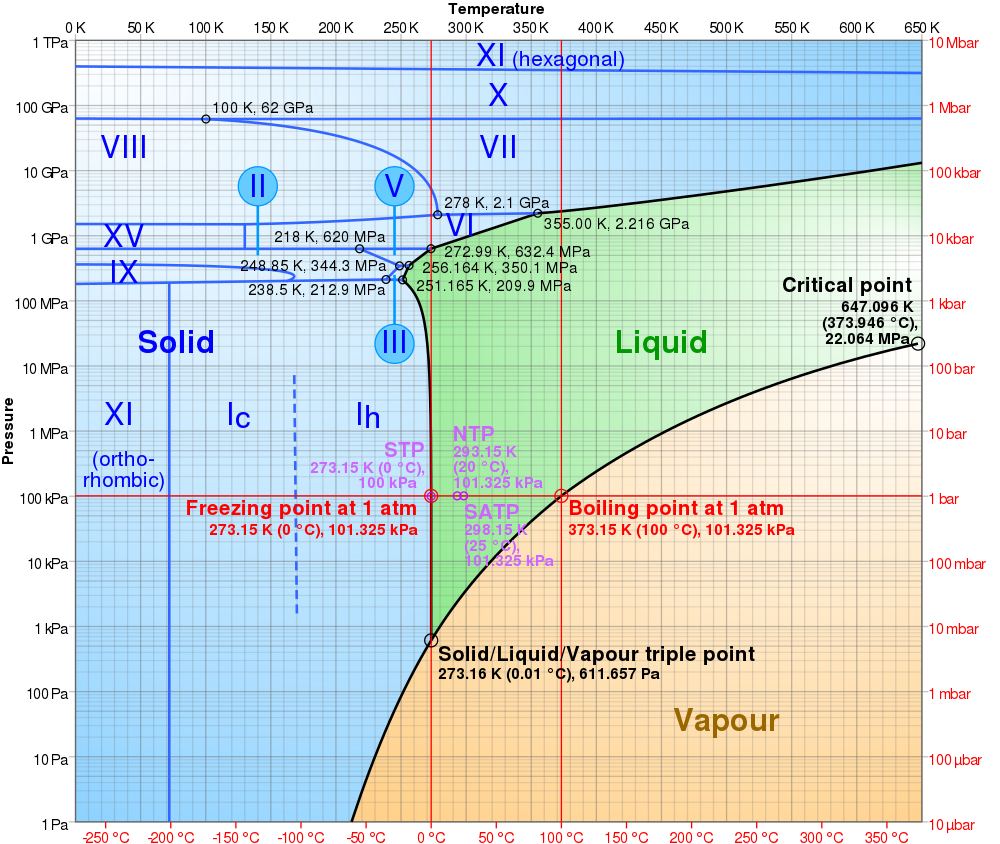
#acessibilidade Diagrama de fases da água considerando diferentes temperaturas e pressões. No eixo X estão as temperaturas em graus Celsius e Kelvin, no eixo Y as pressões em bar e kPa. A área do gráfico está dividida em três cores, vermelho para as condições em que a água manteria estado gasoso, verde para a área de estado líquido e azul para estado sólido.
Como última dica, pendure as camisetas num cabide no varal, aí nem precisa gastar energia passando depois.
Fontes:
Para saber mais:
https://propg.ufabc.edu.br/mnpef-sites/leis-de-conservacao/calor-e-a-primeira-lei-da-termodinamica/
Vídeo “Evaporação da Água – moléculas ao vento” no canal O Incrível Pontinho Azul no YouTube
http://site.sabesp.com.br/site/interna/Default.aspx?secaoId=762


