#acessibilidade: na imagem em destaque há, no centro, uma ilustração de um átomo. Em torno dele há desenhos de pessoas flutuando. Os desenhos estão com as dimensões fora de proporção, com o átomo maior que as pessoas, o que não condiz com a realidade, sendo apenas ilustrativo.
Na primeira parte da nossa viagem falamos sobre os elétrons de valência e onde eles se encontram no Universo que nos cerca. Para encerrar a jornada, falaremos agora sobre tridimensionalidade, flutuação e sua correlação com essas pequenas partículas. Bora lá?
Comecemos com a tridimensionalidade. Para exemplificar, vou usar duas moléculas que certamente todos conhecem: o amido e a celulose. Podem usar como referência do amido, a Maizena® e, para a celulose, uma folha de papel sulfite, uma folha de planta ou casca de árvore. Tanto o amido como a celulose são moléculas muito muito muito grandes, chamadas de polímeros. Os polímeros são macromoléculas com diversas unidades de repetição, conectadas em uma extensa cadeia; como se fosse um colar de pérolas. Além de serem polímeros, o amido e a celulose têm mais algo em comum: a unidade de repetição dos polímeros é a glicose. Em ambos, só tem glicose conectada à glicose, nada mais.
Vamos recordar que o amido se dissolve em água e a celulose dá estrutura e resistência mecânica a todas as plantas de nosso planeta; isto é, não se dissolve em água. Como é possível o mesmo composto gerar macromoléculas tão diferentes?
Ufa, chegamos à tridimensionalidade….
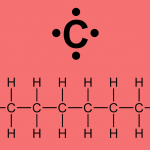
Comecemos com as representações gráficas da glicose. A fórmula mínima (Figura 1A) nos diz quantos e quais átomos estão presentes na estrutura da molécula. É simples, representa a glicose mas não nos mostra a conectividade dos átomos. Na Figura 1B, vemos como estão conectados os átomos, porém não é possível saber como eles estão orientados espacialmente. Com a representação da Figura 1C podemos ver claramente que cada ligação tem uma orientação bem definida no espaço [1]. Apesar de estar desenhada na tela, que é bidimensional, sabemos agora como a glicose é no mundo microscópico, no mundo real, no universo tridimensional.
Aí vem a pergunta: por que a glicose é tri e não bidimensional?
Para responder, precisamos voltar à Parte 1 da nossa viagem, quando falamos de repulsão eletrônica. Recapitulando: elétron repele elétron. Lembrou? Ok, sigamos. Vou isolar e representar graficamente aquele pedaço destacado em verde da glicose para explicar a orientação espacial das ligações no entorno dos átomos de carbono [2].
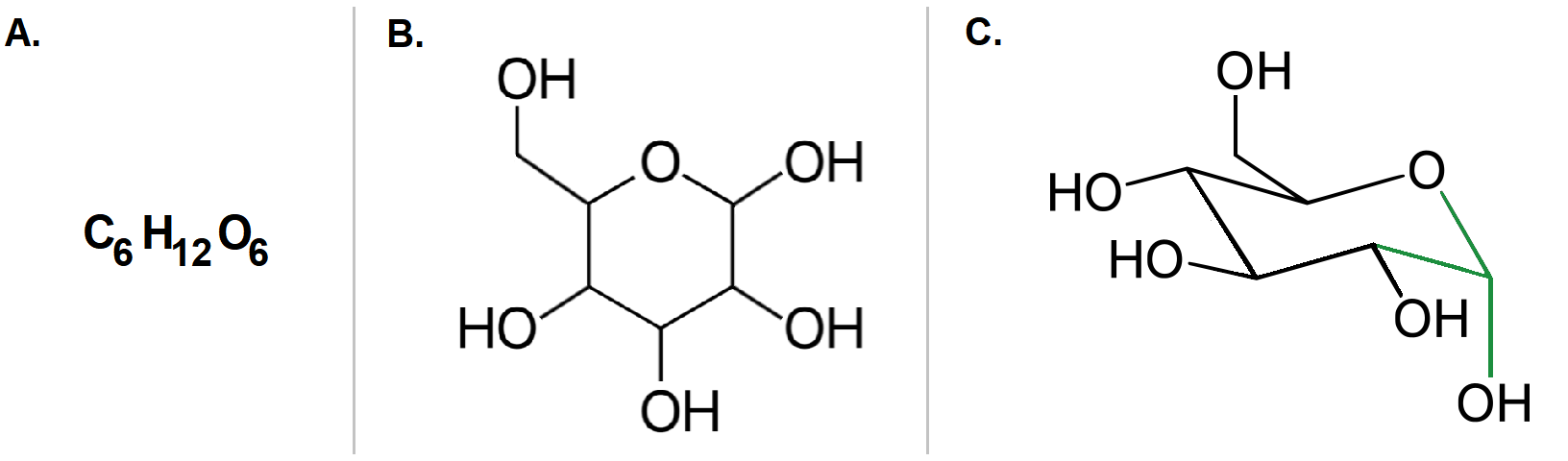
Neste exercício de observação, a Figura 2A mostra todas as ligações “chapadas” no plano da tela: é a representação bidimensional, onde o ângulo entre as ligações é de 90º. Nas Figuras 2B e 2C, as mesmas ligações usam a terceira dimensão para se organizar no espaço. Nelas, as ligações se distanciam entre si em ângulos próximos de 109,5º [3]. Pode parecer pouco, mas é uma diferença significativa em termos de estabilidade, pois não estamos falando de elétrons contidos em apenas quatro ligações: são inúmeras ligações na molécula de glicose, que acumuladamente se afastam de forma mais adequada, reduzindo o efeito desestabilizador de inevitáveis repulsões eletrônicas.
Quero reforçar aqui que para ser glicose, a conectividade dos átomos e a orientação espacial das ligações tem que ser exatamente aquela apresentada na Figura 1C; com um porém: a hidroxila (OH) ligada ao carbono “verde” pode estar direcionada para cima, assim como para baixo (Figuras 2B e 2C). Calma que tudo fará sentido em breve!
Até aqui, espero que tenham entendido o efeito da repulsão eletrônica na orientação espacial das ligações usadas como exemplo. Precisamos avançar um pouco mais para entender, de forma simplificada, como os pares de elétrons contidos nas ligações geram efeitos macroscópicos, alterando propriedades químicas da glicose, molécula esta que vai interagir com o ambiente que a cerca.
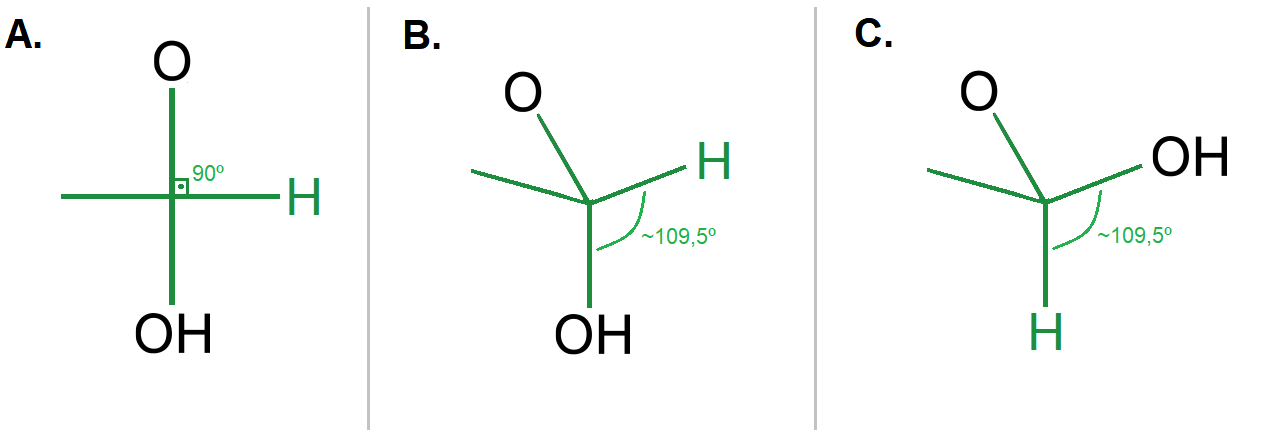
Quando duas moléculas de glicose se conectam, ocorre uma reação química. Ligações têm que ser quebradas para se formarem novas ligações (lembre-se que o carbono só pode fazer quatro ligações e o oxigênio duas). No caso dos dois polímeros que estamos comparando, vamos analisar a conectividade de todas as “pérolas do colar”. Em ambos, as glicoses se conectam sempre entre o carbono 1 de uma glicose com o carbono 4 de outra molécula (Figura 3). E o conector, é um átomo de oxigênio. No amido, as glicoses se conectam única e exclusivamente entre o oxigênio que está apontado para baixo no carbono 1 e na celulose através do oxigênio que está apontado para cima (Figura 3).
Ao se conectar de forma sequencial, os polímeros criam fibras e uma vez sobrepostas, interagem entre si. Se a fibra é plana (Figura 3A), sem dobras nem zigue-zague, elas se sobrepõem de maneira eficiente. Caso tenham dificuldade de se sobrepor, por conta de dobras ou degraus (Figura 3C), as fibras não conseguem se empacotar e isso muda suas propriedades. Elas podem, por exemplo, interagir melhor com a água.
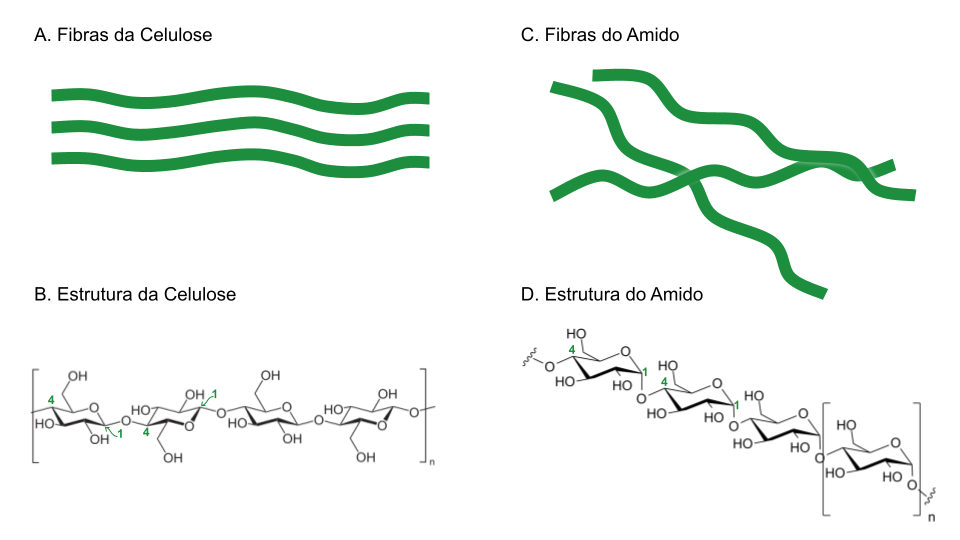
Olhe a Figura 3 e veja que ao usar o oxigênio apontado para cima, no carbono 1, a sequência de glicoses na celulose forma uma longa cadeia sem degraus. Uma fibra encontra a superfície da outra e elas vão se empacotando, não deixando espaço para as águas se ancorarem. Já no caso do amido as coisas são bem diferentes. A possibilidade de encaixe de uma fibra em cima da outra é mínima. Então essas fibras ficam dispersas, ou parcialmente empacotadas, deixando muitos pontos de contato entre a água e as fibras do polímero [4]. Por conta desta “pequena” diferença de arranjo espacial das ligações no carbono 1 da glicose, o amido é solúvel em água e a celulose não se dissolve na água. Se o mundo fosse bidimensional, não teríamos essa diferenciação. Incrível, né?
– Mas e a flutuação? – você me pergunta
Até onde chegamos, sabemos que na “casca” de todas as moléculas estão os elétrons de valência, aqueles mais externos, distribuídos em orbitais moleculares. Toda e qualquer molécula terá estes elétrons como sendo o seu primeiro ponto de contato. Se somos feitos de moléculas e tudo o que nos veste, nos circunda também o é, pergunto: como sua roupa pode encostar em uma cadeira? A resposta é – não pode! Ao se aproximarem, em escala nanométrica [5], os elétrons de valência das duas superfícies se repelem e tudo que está envolto por essa camada eletrônica se afasta. Ou seja, um átomo jamais toca no outro. Uma molécula não encosta em outra. Portanto, entre sua roupa e a superfície onde você está, cadeira, cama, sofá… ; não há nada. Você está flutuando agora. Flutuou no passado e continuará assim para todo o sempre.
Somos dessa matéria/ De que todos são feitos, e nossa vida é breve/ Ela é rodeada pelo absoluto nada, é etérea.
William Shakespeare, A Tempestade (1610-1611). Adaptado [6].
Notas e Referencias:
[1] Para quem não lembra, as linhas simples que conectam os carbonos aos carbonos e aos oxigênios são representações gráficas das ligações químicas. Nas representações gráficas apresentadas, a letra “C” referente ao carbono é omitida, assim como as ligações C-H. Este é um recurso didático ; para simplificar a visualização daquilo que está ligado ao carbono. É importante deixar claro que o carbono faz 4 ligações. Os carbonos são os elos de conexão entre todas as ligações e as letras o “O” e “H”, são o oxigênio e o o hidrogênio respectivamente.
[2] Foram representadas três de inúmeras possibilidades de orientações espaciais para as 4 ligações que se conectam ao nosso carbono em estudo.
[3] para o carbono com essa conectividade, sua geometria espacial é denominada tetraédrica.
[4] saliento aqui que a noção de fibra alongada e fibra zigue-zagueada é um modelo pedagógico que utilizei para simplificar a visualização. Na natureza, acontecem outras interações que moldam estes polímeros, que os levam a uma situação de maior estabilidade. Ainda assim, tudo que eu falei continua válido: amido solubiliza em água e celulose não. Caso queira ir além, clique neste link seguro https://www3.nd.edu/~aseriann/amylose.html e veja um pouquinho da estrutura supramolecular da amilose, um dos polímeros da classe dos amidos.
[5] 1 nanômetro corresponde a 0,000000001 metros
[6] Eis um trecho do livro “A Tempestade“, do dramaturgo inglês William Shakespeare. Por obra do destino, o trecho que transcrevi caiu no meu colo (sem tocá-lo, obviamente) no momento em que eu estava juntando as peças do artigo que vocês acabaram de ler. Ela me inspirou e me deu um norte. Eu fiz uma pequena adaptação no trecho original, para que se alinhasse ao tema do artigo. Acho que o William vai entender…